近日,我院郭凯教授团队在国际顶级期刊Angewandte Chemie International Edition发表题为“Sequence Similarity Network Guided Discovery of a Dehydrogenase for Asymmetric Carbonyl Dehydrogenation”的研究论文。我院胡玉静副教授和硕士研究生陈杰为本文共同第一作者,郭凯教授为论文通讯作者,杭州师范大学王志国副研究员和西湖大学叶宇轩研究员为论文共同通讯作者。
含远端γ-立体中心的手性烯酮是众多天然产物和生物活性分子的基本结构单元,例如用于治疗风湿性关节炎的药物可的松以及雄激素睾酮等。但合成此类化合物仍然是有机化学中的重大挑战。现有的合成方法通常需要复杂的起始原料和/或高负荷的复杂有机/金属催化剂,且在去饱和过程中难以实现精确的立体化学控制。生物催化具有环境友好、反应条件温和、选择性高等一系列优势,已经成为传统有机合成的重要补充或替代方法。然而,一系列挑战依然存在。我们团队之前探索了烯还原酶两次脱氢去饱和化合成苯酚类似物的功能(Angew. Chem. Int. Ed., 2024,https://onlinelibrary.wiley.com/doi/full/10.1002/anie.202408359),但其催化合成手性烯酮的效率较低。自然界中已广泛识别和鉴定的脱氢去饱和化酶非常罕见,此外,现有的一些酶虽然具有此类功能,但往往来源于其催化混杂性,通常表现出较低的脱氢酶活性(周转频率,TOF < 10 h-1),并且伴随有难以控制的过度脱氢反应。
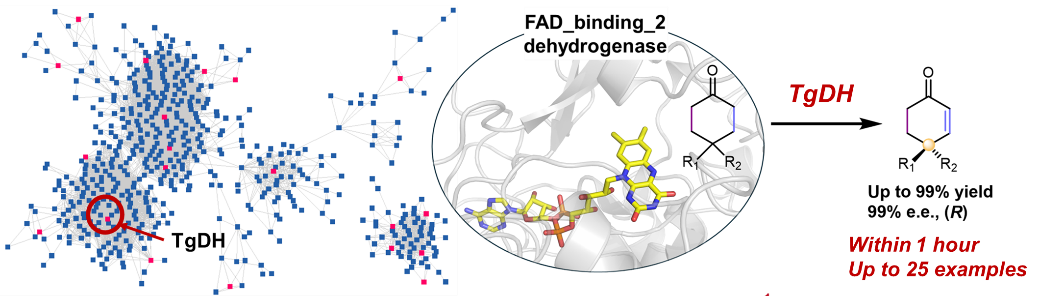
针对现有脱氢去饱和化酶活性差、选择性不高以及容易发生过度氧化反应等问题,本研究通过采用序列相似性网络挖掘大量潜在的脱氢酶序列,确定了一种黄素腺嘌呤二核苷酸(FAD)依赖型酶TgDH。该酶能够不对称地使环己酮类化合物去饱和化,从而构建远端γ-立体中心。与现有的生物催化剂相比,该酶的TOF提高了178倍,且过度氧化很少,实现了较高的对映体过量(> 99% e.e)和转化率(高达99%,一小时内)。此外,该酶还展示了用于克级制备的可操作性,这对工业应用至关重要。与之前报道的酶相比,TgDH在不需要酶纯化的情况下就能提供更强的催化性能,并且在更温和的条件下运行,在更短的反应时间内提供更高的效率。
本工作得到了国家重点研发计划和国家自然科学基金的支持。
全文链接:
https://onlinelibrary.wiley.com/doi/10.1002/ange.202501425
此外,本团队酶催化研究方向拟招收数名研究生,有意向的同学请发邮件到yjhu@njtech.edu.cn。
文:胡玉静;单位:生工学院;审核:庄伟

